Im gleichen Maße wie die Entwicklung und Produkteinführung biologischer Wirkstoffe zunimmt, steigen die meist regulatorischen Anforderungen an diese oft lebensrettenden Arzneimittel. Gleichzeitig ergeben sich durch die Entwicklung innovativer Analysentechniken immer neue Untersuchungsmöglichkeiten.
Da der Anteil an großen Proteinen (etwa monoklonalen Antikörpern oder hochmolekularen Polypeptiden) bei den biologischen Wirkstoffen weiterhin anwächst, rückt eine wesentliche Herausforderung in den Fokus der Prozessentwicklung und Überwachung: die Partikelanalyse.
In injizierbaren Medikamenten können während der Herstellung und dem Transport aufgrund verschiedener Ursachen Partikel entstehen. Biologische Wirkstoffe sind besonders anfällig für Partikelbildung.
Der Grund für die Entstehung von Partikeln kann die Instabilität des Wirkstoffs in der vorliegenden Formulierung sein, aber auch der Herstellprozess selbst kann beispielsweise durch Auftreten zu starker Scherkräfte zur Partikelbildung führen, auf beides ist oft die Denaturierung des Proteins zurückzuführen.
Denaturierte Proteine können inaktiv sein und damit die Wirkung des Arzneimittels verringern. Zudem können sichtbare und nicht-sichtbare Partikel unerwünschte Immunreaktionen beim Patienten hervorrufen, wodurch Nebenwirkungen des Arzneimittels hervorgerufen werden können.
Aufsichtsbehörden haben auf diese Tatsachen mit stärkeren Regulierungen rund um das Thema Partikel reagiert. Beispielsweise wurden in den USA entsprechende Anforderungen in den Kapiteln <790> und <1790> der United States Pharmacopeia (USP) überarbeitet bzw. verschärft. Die Behörden bieten damit Orientierung bei der optische Kontrolle von abgefüllten Einheiten bezüglich sichtbarer Partikel in injizierbaren Medikamenten.
Auch die Europäische Arzneimittel-Agentur (EMA) hat entsprechende Bestimmungen hierzu erlassen. Zudem werden aktuell die bestehenden Kapitel der entsprechenden Arzneibücher zum Thema nicht-sichtbare Partikel überprüft, bzw. erweitert.

Partikelcharakterisierung
Heutzutage erwarten Zulassungsbehörden, dass Herstellungs- und Transportprozesse so entwickelt, validiert und etabliert werden, dass die Entstehung von Partikelkontaminationen oder anderen Verunreinigungen minimiert werden.
Um dies zu gewährleisten, ist eine profunde Kenntnis der Prozesse entscheidend. Ebenso zählen wissenschaftliche Expertise zur Partikelcharakterisierung und -identifizierung, wie auch die analytischen Technologien hierzu.
Nur im Zusammenspiel dieser Kenntnisse können robuste und zulassungsfähige Herstellprozesse entwickelt werden.
Neben der Proteindenaturierung können Partikel durch viele andere Ursachen entstehen, wie z.B. durch Eintrag von Zellulosefasern bei Reinigungsarbeiten, durch Metall- oder Teflonabrieb oder Materialien wie Silikonöl oder Gummi, welche in der Primärverpackung enthalten sind. Die Partikel können zwischen dem nicht-sichtbaren (Nanometer bis niedriger Mikrometerbereich) und sichtbaren (etwa ab 100 - 150 µm) Größenbereich variieren.
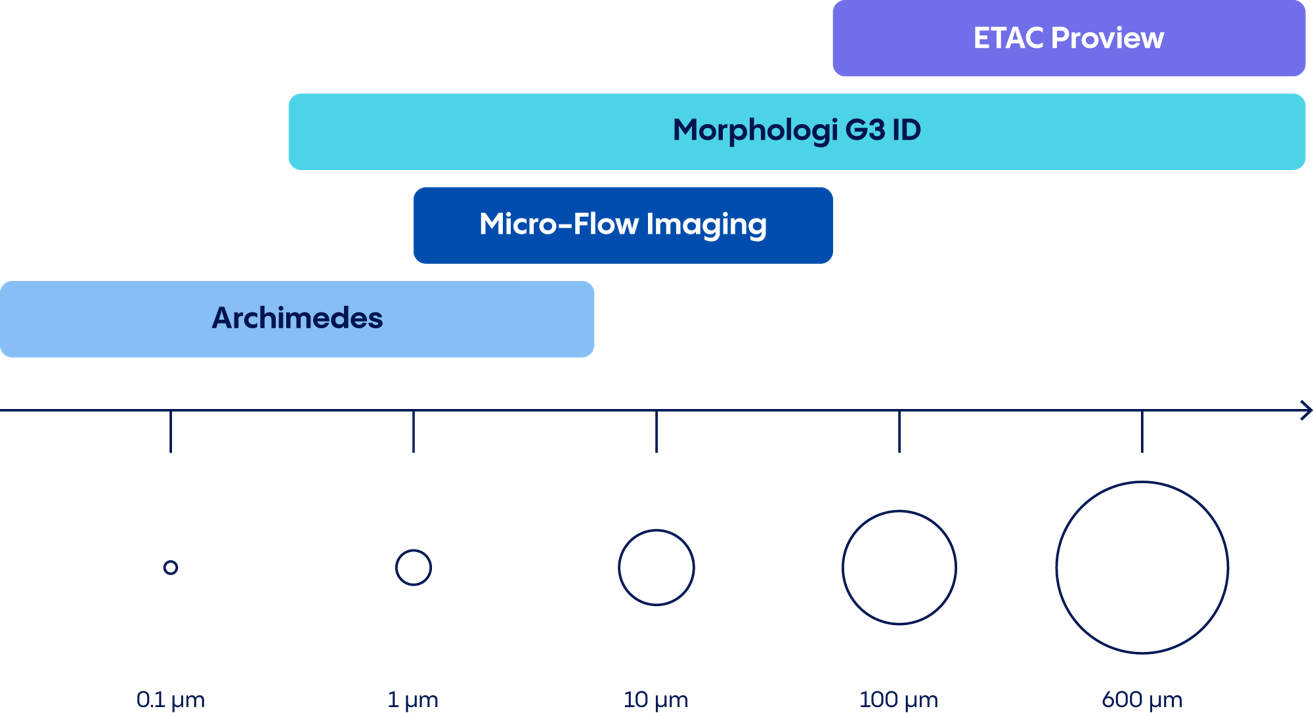
Das Standardverfahren, um nicht-sichtbare Partikel nachzuweisen, ist heute die Messung mittels Hiac Royco. Dieses Gerät bestimmt die Anzahl und die Größe nicht-sichtbarer Partikel im Bereich von 1 – 100 µm. Eine Partikelcharakterisierung oder Identifizierung ist mit diesem Gerät nicht möglich. Das Standardverfahren, um sichtbare Partikel nachzuweisen ist eine visuelle Kontrolle der abgefüllten Einheiten und die subjektive Beschreibung der sichtbaren Verunreinigungen, wenn vorhanden.
Unterschiedliche etablierte Verfahren haben die Wissenschaft der Partikelanalyse weiter vorangebracht und können eine weitreichende Partikelcharakterisierung und -Identifizierung liefern:
Micro-Flow Imaging:
Mit dem MFI werden die Möglichkeiten von digitaler Mikroskopie mit moderner Mikrofluidik kombiniert. Hierdurch werden hochauflösende Bilder von nicht-sichtbaren Partikel zwischen 1 µm und 70 µm erzeugt. Eine Partikelanzahl und -Größenbestimmung ist damit ebenso möglich wie eine Partikelcharakterisierung mit Hilfe moderner Applikationssoftware aufgrund der Morphologie der Partikel.
Resonanzmassenmessung:
Die Resonanzmassenmessung mittels Archimedes ist ein Verfahren, um nicht sichtbare Partikel im Submikrometer-Bereich in einer Probe zu bestimmen. Wird ein Partikel zwischen 50 nm und 5 µm durch einen Mikrofluidik-Kanal transportiert, ändert sich dadurch die Resonanzfrequenz einer Messnadel (Kantilever), wodurch Auftriebsmasse, Trockenmasse und Größe des Partikels berechnet werden.
Die Detektion von Partikeln mit unterschiedlichem Auftrieb ermöglicht beispielsweise in einem Arzneimittel Proteinaggregate von Silikonöltropfen zu unterscheiden.
Digitalmikroskop gekoppelt mit Raman-Spektroskopie:
Das Morphologi G3-ID bietet ein einzigartiges Verfahren, indem es die automatisierten statischen Imaging-Funktionen eines hochauflösenden, modernen Mikroskops mit der chemischen Identifizierung der einzelnen Partikel unter Verwendung der Raman-Spektroskopie kombiniert. Dieses Verfahren kann genutzt werden, um Partikel über einen sehr breiten Größenbereich (1 µm – 1000 µm) nach Größe und Morphologie zu klassifizieren und chemisch mittels Raman-Spektrum zu identifizieren.
Digitale visuelle Inspektion im Labormaßstab:
Mit dem ETAC Proview steht ein computer-gestütztes automatisiertes Inspektionssystem zu Forschungs- und Entwicklungszwecken zur Verfügung. Damit kann die manuelle Aussehensprüfung objektiviert werden, indem hochauflösende Fotos oder Filmaufnahmen der abgefüllten Einheiten aufgenommen und gespeichert werden. Mit Hilfe innovativer Applikationssoftware ist eine Auswertung auf sichtbare bewegliche und unbewegliche Partikel in jeder Einheit präzise möglich.
Vetter Center of Excellence Partikelanalyse
Vetter bietet modernste Technologie und neueste Verfahren in seinem Center of Excellence für die Partikelanalyse der Abteilung Project & Service Analytics. Unsere in-house Expertise und unsere umfassenden Services können Ihnen dabei helfen, die erhöhten regulatorischen Anforderungen in diesem Bereich zu erfüllen und weiterhin die hohen Standards an die Herstellungsqualität aufrechtzuerhalten.

