Durch ein herausforderndes Kapitalumfeld stehen Arzneimittelhersteller in den frühen Phasen von klinischen Studien zunehmend unter Druck, diese so schnell und effizient wie möglich durchzuführen. Angesichts knapper finanzieller Mittel können sich diese aufstrebenden Unternehmen selten kostspielige Rückschläge in ihren klinischen Entwicklungsprogrammen leisten.
Mehr denn je benötigen diese Innovatoren strategisches Vorgehen und fachkundige Unterstützung bei der Durchführung einer Erstanwendung am Menschen.
Während dieses Prozesses kann die richtige Contract Development and Manufacturing Organization (CDMO) mehr als nur ein reiner Dienstleister sein – sie kann zum entscheidenden Partner in dieser kritischen frühen Phase der Produktentwicklung werden.
Nachfolgend habe ich fünf wichtige Möglichkeiten aufgeführt, wie eine CDMO für klinische Studien den erfolgreichen Start unterstützen kann.
Sie möchten nicht den ganzen Artikel lesen? Sie können sich auch unseren aktuellen Webcast zum Thema ansehen:

1. Produktionsplanung Ihres klinischen Prüfmaterials (CTM)
Bei injizierbaren Arzneimitteln ist der Übergang von der Benchtop-Produktion zur cGMP-konformen klinischen Herstellung ein entscheidender Entwicklungsschritt, der weit mehr umfasst als nur die Skalierung der Produktion eines aktiven pharmazeutischen Wirkstoffs (API).
Für einen Arzneimittelkandidaten ist dieser wichtige Schritt oftmals mit mehreren Neuerungen verbunden:
- Das erste Mal, dass ein Wirkstoff in einer für den Menschen geeigneten Dosisform hergestellt werden muss
- Zum ersten Mal wird der Wirkstoff in einer professionellen Produktionsumgebung und nicht in einem Labor hergestellt
- Das erste Mal, dass ein Partner Ihre analytischen Testmethoden einsetzen und interpretieren muss
- Das erste Mal, dass die Herstellungsprozesse des Produkts von den Aufsichtsbehörden überprüft und genehmigt werden
Um jeden dieser wichtigen Schritte erfolgreich zu meistern, sind Erfahrung, sorgfältige Planung und technisches Fachwissen erforderlich – insbesondere bei der Herstellung steriler Injektabilia.
Im Folgenden beschreibe ich, wie eine CDMO für klinischen Studien hier wichtige Unterstützung leisten kann:
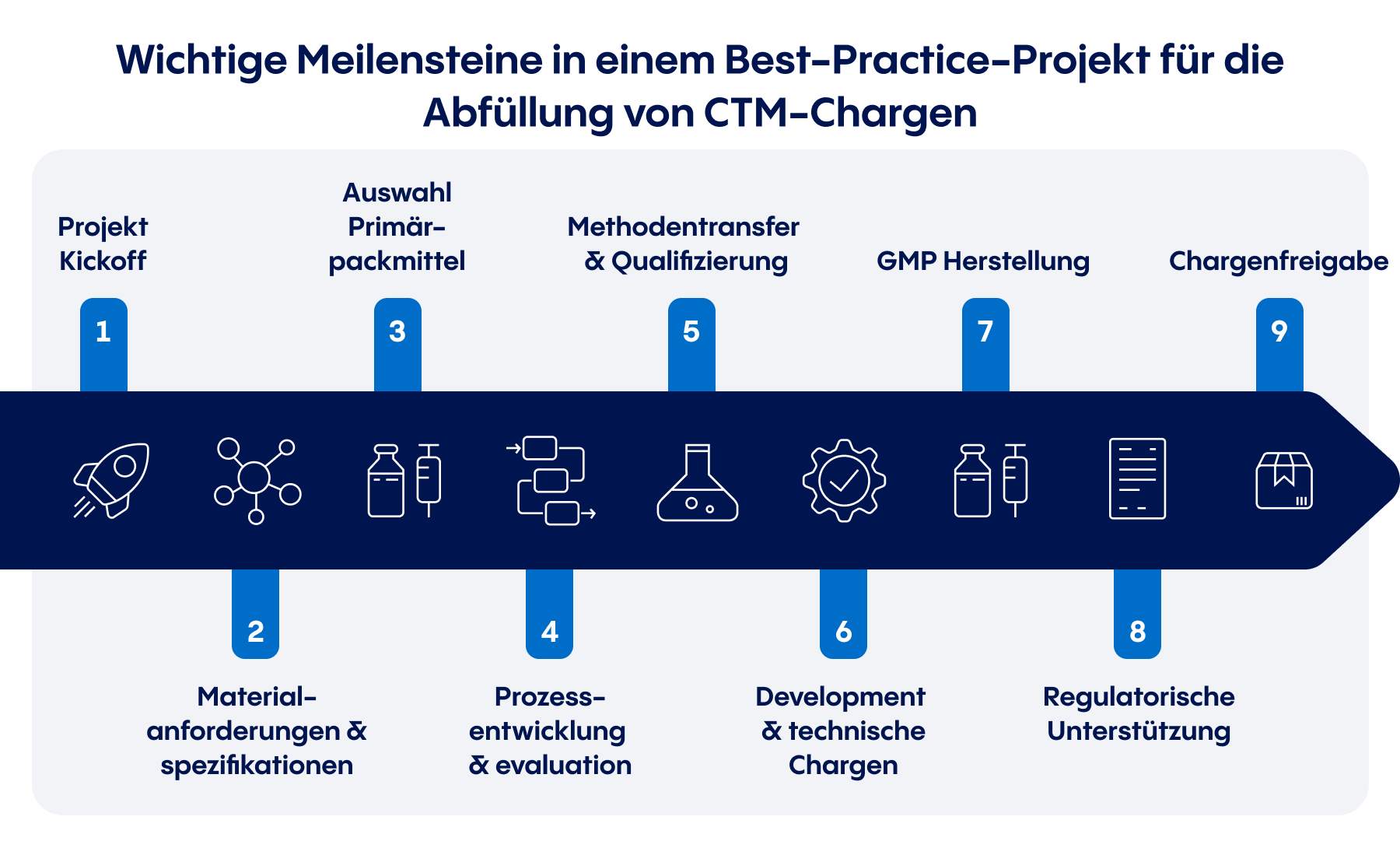
- Ermittlung des Entwicklungsbedarfs: Die richtige CDMO für Ihre klinischen Studien kann Ihnen dabei helfen, die bisher geleistete Entwicklungsarbeit zu bewerten, die notwendigen nächsten Schritte aufzuzeigen und realistische Zeitpläne für das klinische Prüfmaterial festzulegen, die den hohen Anforderungen für die Anwendung am Menschen entsprechen.
- Regulatorische Unterstützung: CDMOs, die Erfahrung mit klinischen Studien haben, kennen die Erwartungen der Regulierungsbehörden für verschiedene Wirkstoffe und Darreichungsformen. Der richtige Partner kann wertvolle Erkenntnisse liefern, die die Einhaltung der Vorschriften proaktiv unterstützen.
- Bewertung des Wirkstoffs: Eine fachkundige CDMO für klinische Studien ist in der Lage zu bestimmen, wie viel Wirkstoff für die Herstellung einer Zielmenge an CTM benötigt wird, aber auch, wie dieser Wirkstoff während der klinischen Herstellung gehandhabt, gelagert und geschützt werden muss.
- Erstellung eines Zeitplans für das Projekt: Die Zusammenarbeit mit einem erfahrenen Fertigungspartner kann einem Arzneimittelentwickler helfen, einen fundierten, strategischen Fahrplan für sein CTM-Projekt zu erstellen. Dies ist sowohl für die Zeitplanung als auch für die Budgetierung von entscheidender Bedeutung.
Auch wenn einige Meilensteine je nach Produktformulierung, Verpackung und weiteren Faktoren variieren können, folgen die meisten CTM-Projekte für injizierbare Arzneimittel einem ähnlichen Ablauf wie dem oben dargestellten. Ein strategischer CDMO-Partner kann seinen Kunden dabei helfen, jeden Schritt so effizient wie möglich zu gestalten und Phase I, II und III Studien auf Kurs zu halten, damit sie rechtzeitig beginnen können.
2. Bewertung: Ist Ihr API bereit für die klinische Herstellung?

Für die Entwickler von Arzneimitteln bedeutet der Wechsel vom Labor in die Klinik auch eine erhebliche Verlagerung des Fokus: von der Erforschung des Wirkstoffs oder Moleküls zu der Frage, wie er in dem für klinische Studien erforderlichen Umfang und in der erforderlichen Qualität hergestellt werden kann.
Um diesen Übergang sicher und effizient zu gestalten, muss eine erfahrene CDMO viele neue Dimensionen des Wirkstoffs bewerten und verstehen - einschließlich der Eigenschaften, die definieren, wie er in einer professionellen aseptischen Abfüllumgebung gehandhabt werden muss.
Wenn sie mit den Komplexitäten der Sterilherstellung vertraut sind, wird die CDMO eine gründliche Bewertung vornehmen wollen:
- Produktformulierung: Eine erfahrene CDMO kann dabei helfen, festzustellen, ob die derzeitige Produktformulierung für eine klinische Studie der Phase I, II oder III optimal ist, und bei Bedarf strategische Alternativen vorschlagen.
- Sensitivität: Der richtige Produktionspartner kann auch dabei helfen, Faktoren zu ermitteln, die die Integrität eines Wirkstoffs beeinträchtigen können (z. B. Licht, Temperatur, Trübung), und die Produktionsprozesse entsprechend planen.
- Verarbeitungsmethoden: Der Schutz der Produktintegrität und die Sicherheit des Personals haben für jede CDMO oberste Priorität. Dies beginnt mit einer detaillierten Bewertung der Art und Weise, wie ein Wirkstoff in einer sterilen Produktionsanlage vorbereitet, gelagert und verarbeitet werden muss.
- Beschaffung: Um ein CTM-Projekt auf Kurs zu halten, erstellt der Produktionspartner einen detaillierten Katalog der Ressourcen und Materialien, die für die Herstellung eines Arzneimittels benötigt werden, und zeigt auf, wo und wie sie im erforderlichen Umfang beschafft werden können.
Jeder dieser Aspekte kann für den Übergang eines Arzneimittels vom Labor in die klinische Produktionsumgebung entscheidend sein - insbesondere in der frühen Phase der Produktherstellung. Die richtige CDMO für die klinische Produktion kann dabei helfen, Herausforderungen frühzeitig zu erkennen, um sowohl Ihren wertvollen Wirkstoff als auch wichtige Meilensteine für Ihre klinischen Studien zu schützen.
3. Auswahl des optimalen Behältnisses für klinische Studien… und darüber hinaus

Die Auswahl eines Primärpackmittels ist eine der wichtigsten Entscheidungen in der Anfangsphase eines injizierbaren Arzneimittels. Auch wenn Vials aufgrund ihrer gut etablierten Herstellungsverfahren und Zulassungswege traditionell die Standardoption sind, treiben mehrere Marktdynamiken die Arzneimittelentwickler dazu, ihre Perspektive zu einem früheren Zeitpunkt im Produktlebenszyklus zu erweitern.
Wenn es darum geht, andere Optionen zu erkunden, kann eine CDMO Einblicke in mehrere zunehmend wichtige Faktoren geben:
- Sich entwickelnde Patientenbedürfnisse: Formate zur Selbstverabreichung werden immer stärker nachgefragt. Ein strategischer Partner kann daher bei der Entscheidung helfen, wann es am sinnvollsten ist, auf ein spritzen- oder karpulenbasiertes Format umzustellen.
- Deal-Vorbereitung: Eine marktkundige CDMO weiß auch, worauf potenzielle Lizenznehmer bei Übernahmen achten, und kann aufstrebenden Arzneimittelentwicklern helfen, ihre CTM-Projekte entsprechend zu planen.
- Verschiebung der Verantwortlichkeiten im Lebenszyklus: Angesichts des knapper werdenden Kapitals kann ein vorausschauender Hersteller seinen Kunden bei der proaktiven Planung von kostspieligen Meilensteinen - wie beispielsweise einem patientenfreundlichen Format - helfen, die von zukünftigen Lizenznehmern oder Käufern aufgeschoben werden könnten.
Diese drei Überlegungen können bei der Auswahl des Primärpackmittels von großer Bedeutung sein. Vor allem dann, wenn ein Partner für die klinische Produktion hinzugezogen wird, der bereits viele injizierbare Produkte durch Studien der Phase I, Phase II oder Phase III begleitet hat.
Die Kenntnisse dieses Partners können dem Kunden helfen, eine intelligente Auswahl zu treffen, die mehrere nachgelagerte Erfolge unterstützt: Angefangen bei der Wertschöpfung, über die Sicherung der Patientenbedürfnisse bis hin zur Schaffung vorteilhafter Übernahmebedingungen.
4. Transfer und Anpassung Ihrer Analysemethoden

Ein weiterer wichtiger Schritt besteht darin, sicherzustellen, dass Ihr Produkt gemäß den erforderlichen Spezifikationen hergestellt werden kann und dass Ihre CDMO in der Lage ist, die Qualität während des gesamten Prozesses genau zu messen und zu überwachen:
- Methodenbewertung: Von der Identität über die Stabilität und Wirksamkeit bis hin zu Bioburden kann eine CDMO dabei helfen, festzustellen, inwieweit spezielle Analysemethoden für eine neue, größere Testanlage umgerüstet werden müssen.
- SOP-Anpassung: Ein fachkundiger Arzneimittelhersteller kann die Standardarbeitsanweisungen (SOPs) für Arzneimittelprüfung sorgfältig bewerten und den Kunden bei allen Anpassungen, die aus Gründen der Klarheit oder Durchführbarkeit erforderlich sind, unterstützen.
- Qualität durch Design: Um Methoden für die behördliche Aufsicht vorzubereiten, kann eine klinische CDMO dabei helfen, kritische Qualitätsattribute, Prozessparameter, Materialeigenschaften und weitere Faktoren, sowohl in cGMP- als auch in ICH-konformen Herstellungsprozessen, zu definieren.
Im Folgenden werden einige der wichtigsten Testmethoden näher beleuchtet, auf die sich diese Evaluierungen in der Regel bei einem frühphasigen CTM-Projekt konzentrieren.
Ein Herstellungspartner kann dabei helfen, jede dieser Methoden und Verfahren zu bewerten und den effektivsten Weg zu finden, sie vom F&E-Labor in das analytische Prüflabor zu übertragen.
5. Abfüllung Ihrer CTM-Chargen
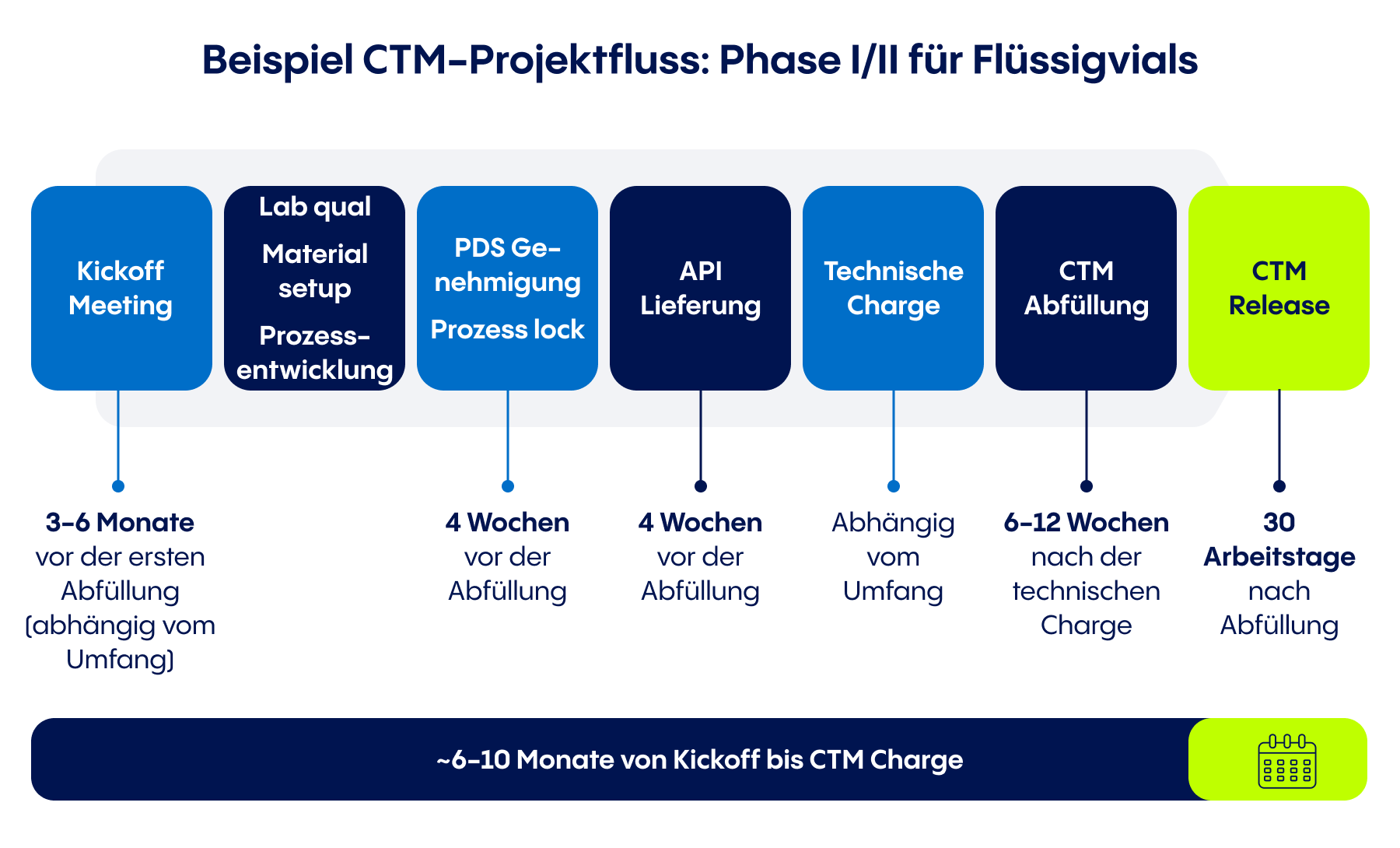
Sobald viele wichtige Faktoren berücksichtigt wurden - einschließlich Zeitplan, Wirkstoff, Packmittel, Analytik usw. - kann eine CDMO mit der Abfüllung des für klinische Studien benötigten Produkts fortfahren.
Ein optimierter Ansatz für diese kritische Charge kann dazu beitragen, Risiken zu mindern, Prozesse zu verbessern und die klinische Studie bis zum Start auf Kurs zu halten.
Um den Erfolg dieses Projekts zu unterstützen, kann ein Produktionspartner bei vielen wichtigen operativen Entscheidungen und Prozessen helfen, wie zum Beispiel:
- Projektplanung: Ein CTM-Abfüllvorgang umfasst viele voneinander abhängige Schritte, die von einer CDMO in einen realistischen, effizienten Zeitplan für die Chargenfreigabe umgesetzt werden können. In der Grafik oben sehen Sie, wie diese Schritte für ein klinisches Chargenprojekt der Phase I oder II für ein flüssiges CTM in Vials aussehen können.
- API-Menge: Um sowohl den Zeitplan als auch das Budget zu wahren, kann eine CDMO dabei helfen, die API-Menge zu bestimmen, die für die Durchführung eines CTM-Abfüllprojekts benötigt wird - unter Berücksichtigung von Linienverlusten, Überschussmengen, Probenahmen für Qualitätstests und anderen Überlegungen.
- Technische Läufe: Dieser vorbereitende Schritt ist zwar nicht erforderlich, kann aber eine wertvolle Möglichkeit sein, die Abfüllprozesse einzustellen und einige potenzielle Risiken zu mindern, bevor der kostbare Wirkstoff dem vollen Produktionszyklus zugeführt wird. In einigen Fällen können technische Läufe sogar mit Placebos durchgeführt werden, um den verfügbaren Wirkstoff zu erhalten.
- Kühlkettenlogistik: Bei tiefgefrorenem CTM kann der mit der klinischen Studie betraute Partner dabei helfen, die notwendigen Schritte für die sichere Verteilung der Chargen an die Zielkliniken zu planen.
Wie Sie die richtige CDMO für Ihre klinische Studien finden

Wie jeder dieser Faktoren zeigt, kann eine CDMO mehr sein als nur eine operative Dienstleisterin - sie kann eine wichtige strategische Partnerin in einer kritischen Phase der Entwicklung eines injizierbaren Arzneimittels sein.
Bei der Auswahl einer CDMO für Ihre klinischen Studien gibt es eine Reihe wichtiger Überlegungen, die diskutiert und bewertet werden müssen, um festzustellen, ob ein Hersteller sowohl für Ihr Produkt als auch für Ihre Projektziele geeignet ist. Der richtige Produktionspartner sollte nicht nur umfassende technische Fähigkeiten, große Erfahrung und hochmoderne Einrichtungen bieten, sondern auch wichtige Vorteile wie:
- Spezialisiertes Fachwissen: Das Know-How über Ihre spezifische Produktarten, Stoffklassen und Verabreichungsformen kann zur Optimierung Ihres CTM-Projektes beitragen.
- Dedizierter Service: Beurteilen Sie die Reaktionsfähigkeit, die Anpassungsfähigkeit und das allgemeine Engagement der CDMOs bezüglich Ihres Projektes. Dies ist besonders wichtig für Unternehmen in der Anfangsphase, die auf diese externe Unterstützung angewiesen sind.
- Klare Kommunikation: Suchen Sie einen Auftragsfertiger, der Klarheit und proaktive Kommunikation über Projekterwartungen, Zeitplanung und mögliche Rückschläge schafft.
- Vorausschauendes Denken: Hat die CDMO ein Auge auf Ihre Entwicklungsziele und Lizenzierungspläne? Sie sollte erkennen, wohin sich Ihr Produkt entwickelt, und Ihnen helfen, frühzeitig Entscheidungen für einen langfristigen Erfolg zu treffen.
Um zu beurteilen, ob ein Herstellungspartner für Ihr Produkt und Ihre klinischen Studien geeignet ist, sollten Sie einige der folgenden Fragen bereits zu Beginn des Auswahlverfahrens klären.
Wenn die CDMO alle Fragen mit "Ja" beantworten kann, ist sie möglicherweise eine gute Wahl für Ihr Projekt zur Herstellung von klinischen Chargen.


