Stabilitätsprüfungen
& Lagerung
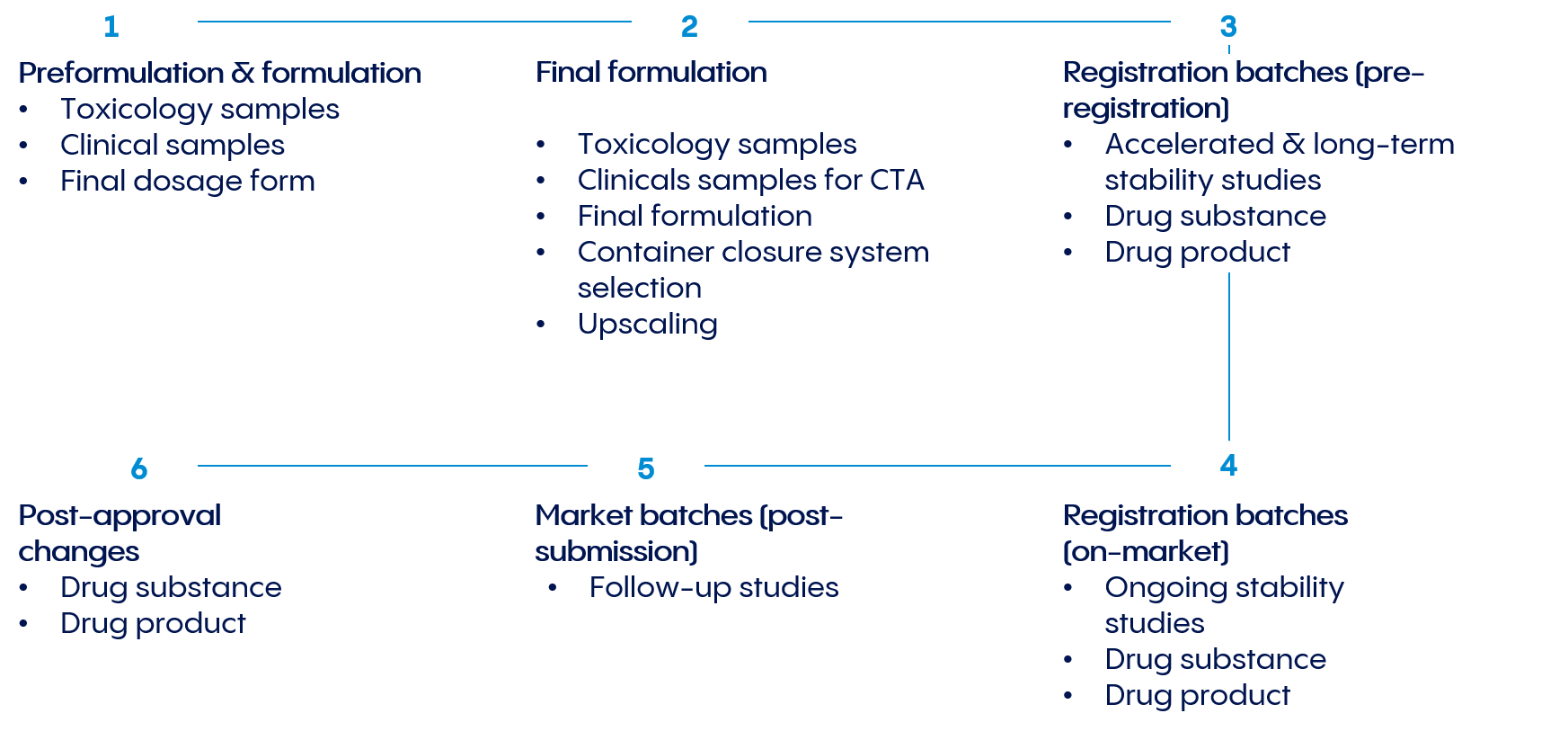
Über den gesamten Produktlebenszyklus hinweg bieten wir ICH-konforme Stabilitätsprogramme, umfassende Stabilitätstests gemäß cGMP-Vorschriften sowie Mustereinlagerung bei Standardtemperaturbedingungen als auch unter Beachtung besonderer Produktanforderungen.