
Von komplexen und hochempfindlichen Substanzen über Impfstoffe bis hin zu biotechnologisch hergestellten Proteinen: Die Herstellung von Arzneimitteln erfordert ein hohes Maß an Fachwissen, um alle Prozesse vor der Fertigstellung des Endprodukts unabhängig voneinander abzudecken.
Eine große Herausforderung besteht darin, Stabilitätsstudien durchzuführen, um jeden Entwicklungsschritt eines Wirkstoffs und eines Arzneimittels zu begleiten. Während der Entwicklung wird mit Hilfe von gut durchdachten Stabilitätsstudien bewertet, welche z.B. Verpackungsmaterialen, Hilfsstoffe und Produktionsprozessparameter zu einem stabilen Produkt führen.
Anschließend werden die Daten zusammengetragen, um das Verfalldatum zu generieren und die Marktzulassung zu erhalten. Das Verfalldatum gibt an, bis wann ein Arzneimittel verwendet und vermarktet werden darf.
Für Pharma- und Biotech-Unternehmen ist entscheidend, dass bei den Studien regulatorische Anforderungen, wie die der ICH Guideline (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use), eingehalten werden.
Gemäß diesen Richtlinien dient die Stabilitätsprüfung dazu, nachzuweisen, wie sich die Qualität eines Arzneimittels im Laufe der Zeit unter dem Einfluss verschiedener Umweltfaktoren wie Temperatur, Luftfeuchtigkeit und Licht ändert, und eine Wiederholungsprüfung für den Wirkstoff oder eine Haltbarkeit des Arzneimittels bei der empfohlenen Lagerbedingung festzulegen.
Manchmal fehlt es kleinen und mittelgroßen Pharma- und Biotech-Unternehmen an Wissen, Lager- und Laborkapazitäten, um alle Prozesse, von der korrekten Lagerung der Stabilitätsmuster über die Etablierung und Durchführung aller erforderlichen analytischen Prüfmethoden, die statistische Auswertung der Daten bis hin zur Erfüllung regulatorischer Anforderungen, abzudecken.
Stabilitätsstudien werden während des gesamten Lebenszyklus eines Produkts durchgeführt. Angefangen bei der ersten Entwicklung der Wirkstoffe bis hin zur Prozessvalidierung des Arzneimittels. Auch Medikamente, die bereits auf dem Markt sind, müssen mindestens einmal jährlich auf Stabilität gelegt werden, um die GMP-Anforderungen zu erfüllen.
Umfangreiche Prüfungen für zuverlässige Ergebnisse
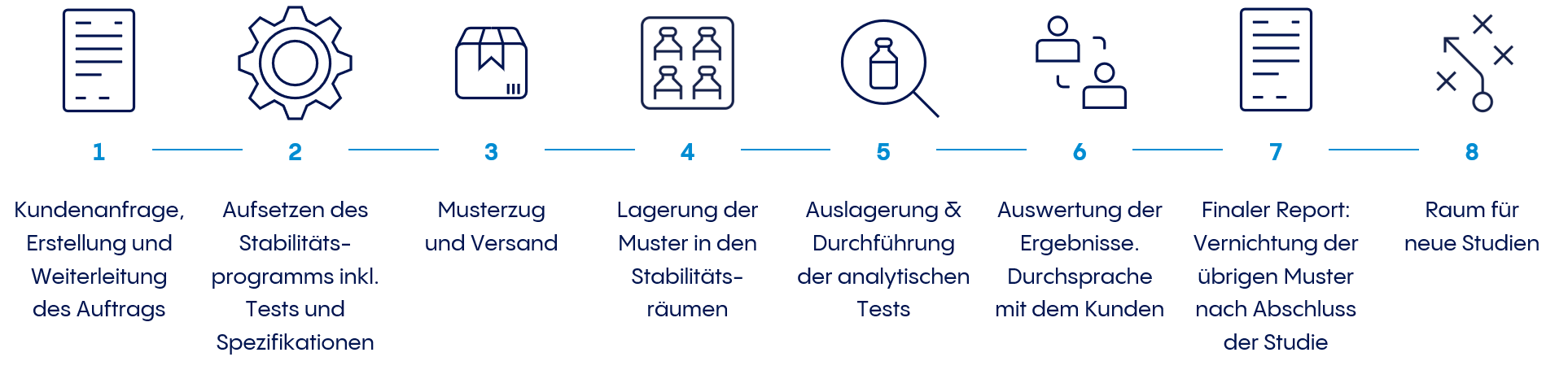
Die Stabilitätsstudien dauern in der Regel zwischen zwei und fünf Jahren. Die Stabilitätsmuster werden in den sogenannten Stabilitätsräumen mit unterschiedlichen klimatischen Bedingungen (Temperatur (° C) und relative Luftfeuchtigkeit (rF)) gelagert. Die so gelagerten Muster werden mit Hilfe eines komplexen Prüfprogramms analysiert, wie sich die Qualität eines Produktes über die vorgegebene Lagerdauer bei unterschiedlichen Lagerbedingungen verändert.
Das kann beispielsweise der Wirkstoffgehalt, Abbauprodukte oder das Aussehen der abgefüllten Lösung sein; z.B. bleibt sie klar oder verfärbt sie sich im Laufe der Zeit? Abhängig von den zuvor definierten Anforderungen werden z. B. auch die Funktionalität des Injektionssystems (Gleitkräfte, Dichtigkeit des Systems, etc.) geprüft. Die Prüfungen werden zu verschiedenen Zeitpunkten durchgeführt, welche für den gesamten Zeitraum der Studie im Voraus geplant wurden.
Muster werden oft unter mehr als einer Lagerbedingung gelagert, um die Ergebnisse zu beschleunigen. Die Muster werden gelagert und müssen zu vorgegebenen Zeiten für die jeweilige Analyse umgelagert oder zur Analytik weitergeleitet werden. Darüber hinaus ist es unerlässlich, die Ergebnisse durch statistische Auswertungen korrekt zu interpretieren.
Zunehmende Komplexität erfordert einen erfahrenen und flexiblen Partner
Die Nachfrage nach Stabilitätsstudien nimmt aufgrund steigender Komplexität und regulatorischer Anforderungen stetig zu. Vetter ist ein erfahrener Full-Service-Provider mit einer starken Expertise im Entwicklungssupport und Lebenszyklusmanagement von Arzneimitteln. Seit 1996 unterstützt Vetter seine Kunden mit einem engagierten Team an erfahrenen Projektmanagern und Experten für Stabilitätsstudien.
Vetter bietet eine Lagerfläche von mehr als 700 m² mit verschiedenen Lagerbedingungen. Um alle Anforderungen der Kunden mit großer Flexibilität zu erfüllen, verfügt Vetter über Stabilitätskammern und -räume, die flexibel an kundenspezifische Lagerbedingungen angepasst werden können.
Pharma- und Biotech-Unternehmen können den Umfang der Dienstleistungen selbst bestimmen. Sie können die ganze Studie bei Vetter durchführen lassen, d. h. inklusive Lagerung der Muster und der dazugehörenden analytischen Prüfung. Kunden, die ihre Arzneimittel für die Stabilitätsstudien im eigenen Haus lagern, können auch individuelle Prüfungen nutzen, die Vetter in den hauseigenen Laboren anbietet. Beispielsweise können sie Muster an Vetter senden, um den Steriltest durchzuführen, wenn sie selbst keine geeigneten Labore dafür haben.
Die Vorteile liegen auf der Hand: Mit einem starken Full-Service-Provider an der Seite können sich Pharma- und Biotech-Unternehmen auf die Weiterentwicklung ihrer Produkte konzentrieren, während eine erfahrene CDMO ihre Stabilitätsstudien koordiniert.

